| 孟祥波 | ||||
| 作者: 来源: 发布时间:2020年05月08日 08:57 浏览次数: | ||||
|
教授,博士生导师,齐鲁青年学者 E-mail: xbmeng@sdu.edu.cn
研究方向:重要免疫受体的翻译后修饰与疾病
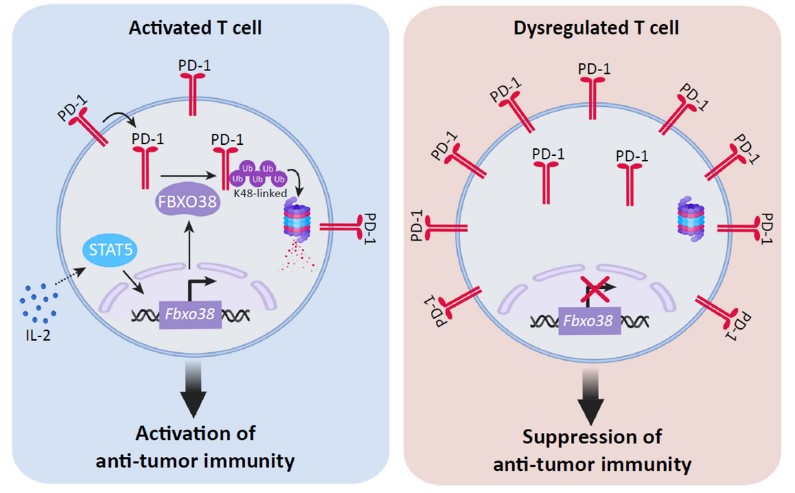
学习和工作经历: 2007-2011年就读于西北农林科技大学,获得理学学士学位; 2011-2018年就读于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,获得理学博士学位; 2018-2020就职于生物化学与细胞生物学研究所; 2020年加入山东大学高等医学研究院,被聘为教授、博士生导师、“齐鲁青年学者”。 研究工作: 为了躲避免疫系统的识别和杀伤,肿瘤细胞可通过多种机制实现免疫逃逸,包括以PD-1为代表的免疫抑制分子在肿瘤微环境中的高表达和持续活化。近年来,肿瘤免疫治疗取得重要进展,最具代表性的是PD-1/PD-L1抗体,已被批准用于非小细胞肺癌、肝癌和胃癌等多种癌症的治疗,说明该通路在肿瘤免疫逃逸中重要作用。但是,这些药物还存在一些不足,比如客观缓解率偏低(15-30%)、缺少有效的分子标记物以及起效患者存在复发风险等。因此,研究这些免疫受体的作用机制具有重要的理论和临床意义。 我们前期的研究工作首次揭示了PD-1分子存在泛素化修饰,鉴定了介导该过程的关键E3连接酶FBXO38,并证明通过调控FBXO38表达可以提高T细胞的抗肿瘤功能。该工作提示免疫受体的泛素化修饰对淋巴细胞抗肿瘤功能具有重要调控作用。 图1. PD-1分子的降解机制(Taryn M. S. et al., Trends in Immunol, 2019)。左:在T细胞活化过程中,PD-1分子发生FBXO38介导的K48位多聚泛素化修饰,保证PD-1分子在合理的水平。右:在肿瘤微环境中,Fbxo38的转录水平降低,导致PD-1表达水平升高,T细胞处于“无能”状态。
在此基础上,我们将综合使用质谱分析、CRISPR/Cas9筛选和多种生化手段鉴定多种多种重要免疫受体的翻译后修饰类型(磷酸化、泛素化和糖基化修饰等),通过多种自身免疫病和肿瘤模型阐明其与疾病发生发展的关系,并发展相应的干预方法。这些研究将拓展我们对T细胞抗肿瘤机制的认识,可能为相关疾病的临床治疗和诊断提供潜在靶点。 代表论文: 1. Meng, X., Liu, X., Guo, X., Jiang, S., Chen, T., Hu, Z., Liu, H., Bai, Y., Xue, M., Hu, R., Sun, S., Liu, X., Zhou, P., Huang, X., Wei, L., Yang, Wei., & Xu, C. FBXO38 mediates PD-1 ubiquitination and regulates anti-tumour immunity of T cells. Nature 564, 130-135, doi:10.1038/s41586-018-0756-0 (2018). 2. Yang, W., Bai, Y., Xiong, Y., Zhang, J., Chen, S., Zheng, X., Meng, X., Li, L., Wang, J., Xu, C., et al. (2016). Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism. Nature 531, 651-655. |
||||
| 上一条:王军成 | ||||
| 下一条:齐晓朋 | ||||
|
【关闭】 |